Il potere tampone in acquario
Avvicinarsi al mondo dell’acquariologia vuol dire, che si voglia o meno, dover apprendere qualche nozione scientifica. Termini come GH, KH e pH vengono sciorinati all’improvviso, troppo spessosenza fornire delle solide basi su cosa siano questi valori e a cosa effettivamente servano.
In questo articolo andremo ad approfondire il concetto di potere tampone in acquario, quindi tutto ciò che concerne il KH e tutto quello che gli sta attorno. Il concetto è semplice, ma ci sono diverse sfaccettature che vengono tralasciate e che servono a capire anche come usare alcuni prodotti presenti sul mercato.
1. Le basi: Il KH
Il KH, o durezza carbonatica, è la misura della quantità di bicarbonato e carbonato presenti in una massa d’acqua. Più il valore è alto, più sarà complicato modificare il valore del pH dell’acqua aggiungendo un acido, sia che si tratti di anidride carbonica o di prodotti, naturali o meno, commercializzati allo scopo di abbassare il valore dell’acidità.
Nello stesso momento valori bassi (per dare un numero: pari o inferiori a 2 gradi) renderanno l’acqua molto più suscettibile sia a cali imponenti di pH in seguito all’aggiunta di piccole quantità di un acido, che a brusche risalite nel valore dell’acidità quando questo verrà a mancare.
Un esempio pratico di questa instabilità può essere un innalzamento del pH di quasi un punto durante il fotoperiodo, quando le piante assorbono anidride carbonica, rimuovendola quindi dall’acqua. Oppure l’abbassamento dell’acidità a valori addirittura tossici per gli animali quando le luci si spengono e le piante smettono di assorbire anidride carbonica (se l’impianto di erogazione non dovesse essere chiuso ad esempio tramite una elettrovalvola).
I valori ideali di CO2 in acquario, si dice, vengono ottenuti incrociando su tabelle come quella riportata di seguito, i valori ottenuti dalle letture di pH e KH e facendo in modo che, definito il KH, il pH assuma valori tali da avere una quantità di anidride carbonica disciolta compresa tra 20 e 35 ppm (milligrammi/litro). Valori inferiori penalizzano le piante, valori superiori iniziano ad essere tossici per gli animali.
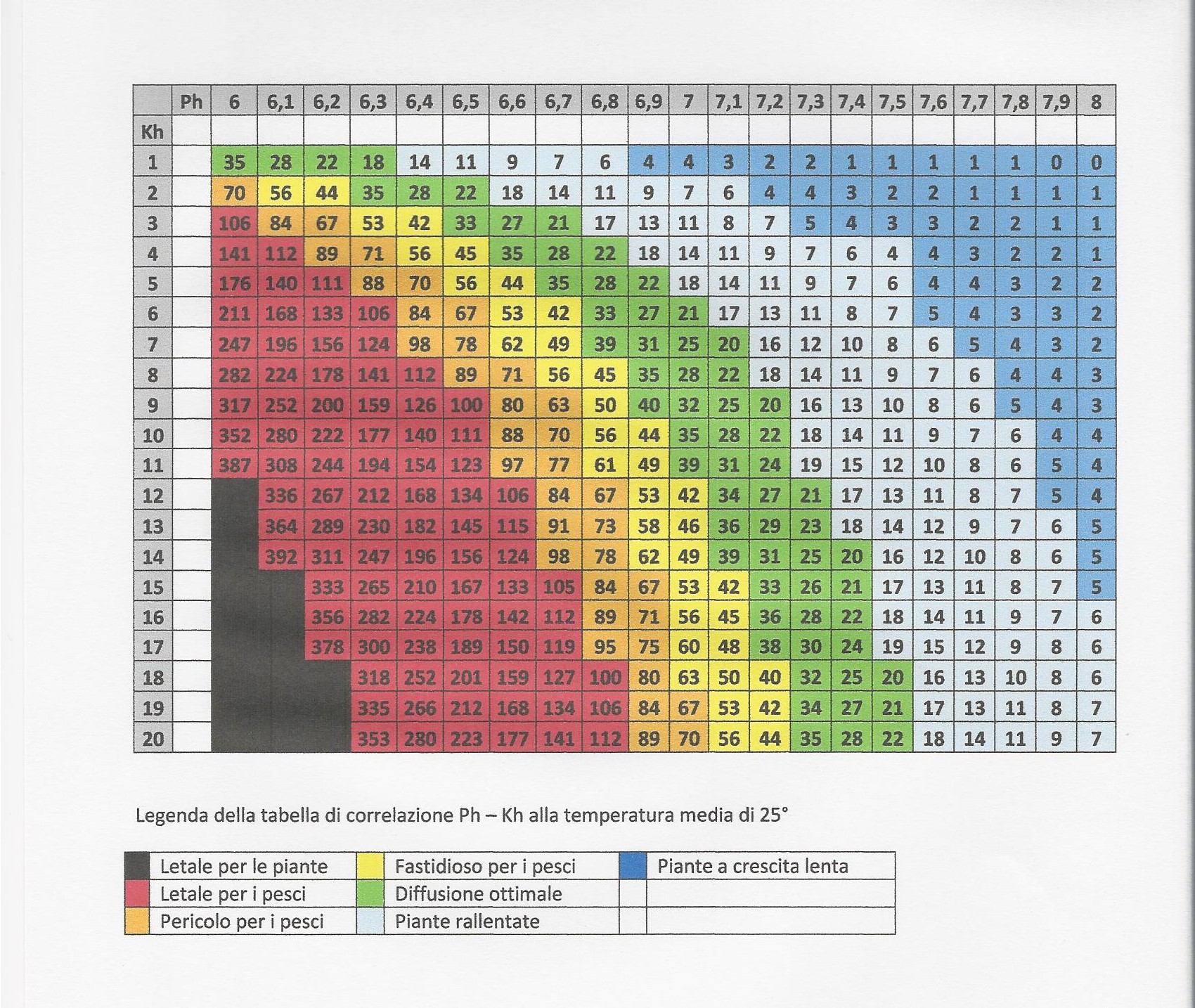
Queste informazioni sono sufficienti per comprendere il meccanismo alla base del valore del KH, e le teniamo per buone per il momento, ma, se iniziamo ad approfondire l’argomento, scopriremo che in alcuni casi i conti non tornano.
Molti appassionati di acquario naturale, ad esempio, si informano sui valori delle acque in cui normalmente vivono alcuni dei pesci d’acqua dolce più comuni, accorgendosi che spesso tali valori sono anche molto più bassi di quelli che riusciamo ad ottenere in un acquario domestico.
Valori di pH compresi tra 4,5 e 6, con valori di KH che spesso oscillano tra 0 ed 1 e, solo in alcuni rari casi, arrivano verso 3-4.
O, ancora, molti fondi tecnici garantiscono di stabilizzare l’acqua a valori di pH pari a circa 6,5, ma remineralizzando l’acqua con il bicarbonato, poi questo valore raggiunge livelli più alti, soprattutto dopo alcuni mesi dalla partenza del progetto.
Come mai allora in natura gli animali vivono e gradiscono valori di acidità così bassi, mentre incasa queste combinazioni di valori causerebbero malessere e boccheggiamento rapido a galla, se non la morte per asfissia?
E perché il mio fondo allofano (pagato non poco) non funziona come dico io?
La risposta è che in realtà la quantità di bicarbonato (KH) è una misura della capacità tamponedell’acqua, che è un concetto più ampio di quanto possiamo immaginare. Andremo di seguito ad approfondire l’argomento, cercando di alleggerire il più possibile i termini matematici, ma ci sarà un po’ da sudare.
Ricordo a tutti che nel caso qualcosa non vi fosse chiaro potrete scriverci sul nostro gruppo Facebook e fare tutte le domande che volete.
2. Il potere tampone
Prima di iniziare questo viaggio nel potere tampone, vorrei rassicurare e chiedere scusa in anticipo ai colleghi chimici e biologi professionisti che potrebbero leggere questo in futuro: sto cercando di lasciare una base più solida al lettore, non di prepararlo per un esame di chimica generale ed inorganica. Perdonatemi se ometto qualcosa che ritenete necessario o taglio in breve in alcuni tratti, ma l’importante, per quanto mi riguarda, è che arrivi il concetto.
Per i lettori meno pratici in termini chimici: potreste trovare ostico il prossimo paragrafo. Me ne scuso, ma ho ridotto il concetto ai minimi termini eliminando quasi del tutto la matematica. Adesso, però, è meglio iniziare.
La capacità tampone di una soluzione è, come già abbiamo avuto modo di vedere con il KH, una misura di quanto la soluzione si oppone alla variazione di acidità in seguito all’aggiunta di piccole quantità di un acido o di una base forte.
Possiamo fare un piccolo esperimento in casa semplicemente prendendo un litro di acqua del rubinetto ed un litro di acqua di osmosi e misurandone il pH. In seguito, aggiungiamo una goccia di acido muriatico alle due bottiglie e ripetiamo la misura di pH: l’acqua di osmosi vedrà il suo pH scendere a valori molto bassi, l’acqua di rete invece manterrà un valore molto simile a quello che aveva in precedenza, soprattutto se il valore del KH supera il valore di 6.
Perchè avviene questo?
2.1 Acidi e basi forti o deboli
Non possiamo definire cosa è un tampone chimicamente senza accennare a cosa sono acidi e basi forti e deboli, e lo facciamo partendo dalla definizione di acido e di base.
Un acido è una sostanza che in qualche modo (ce ne sono diversi) aumenta la quantità di ioni idrogeno (H+) presenti in acqua.
Una base è una sostanza che in qualche modo cattura e quindi diminuisce la quantità di ioni idrogeno presenti in acqua, o aumenta la quantità di ioni idrossile (OH–).
La quantità di ioni idrogeno presenti in acqua definisce il valore del pH.
Per quanto queste definizioni non siano perfette, sono quanto ci serve per continuare con il nostro ragionamento.
Un acido viene definito forte se, una volta disciolto in acqua, libera tutti gli ioni idrogeno che ha legati su ogni sua molecola. Esempi comuni di acidi forti sono l’acido cloridrico, per uso domestico definito acido muriatico, e l’acido solforico, presente nelle batterie delle auto e in alcuni disgorganti per tubature.
Allo stesso modo una base viene definita forte se una volta disciolta in acqua cattura almeno uno ione idrogeno per ogni molecola, o libera uno ione OH– per ogni molecola disciolta.
Basi forti per uso quotidiano sono la soda caustica e la calce, viva o spenta.
Non tutti gli acidi e le basi, però, mostrano questo comportamento: prendiamo ad esempio l’aceto, una sostanza notoriamente acida che tutti abbiamo in casa. Questo è una soluzione in acqua di diversi acidi, il principale dei quali è senz’altro l’acido acetico, che ne costituisce circa il 6%, con un pH che raggiunge circa il valore di 2,4.
Facciamo ora un esercizio di immaginazione: se avessimo il potere di rimpicciolirci e di guardare da vicino le molecole dell’acido acetico, vedremo che non tutte hanno perso uno ione idrogeno ma, anzi, la maggior parte conserva il suo.
Alcune lo perdono mentre alcune ne catturano uno che passa. Questo è il tipico comportamento di un acido o di una base debole.
Se potessimo invece scattare diverse fotografie alle nostre molecole di acido acetico e potessimo contare quanti ioni idrogeno, quanti ioni acetato (molecole di acido acetico che hanno perso l’idrogeno) e quante molecole di acido acetico sono presenti in ogni fotografia, scopriremmo che le prime due quantità sono sempre circa identiche, e che il rapporto tra gli ioni e le molecole rimaste integre è sempre uguale.
Questo rapporto costante viene definito costante di dissociazione acida (pKa).
Più questo valore sarà basso, più il nostro acido sarà forte, ma sarà comunque un acido debole, ovvero non tutte le sue molecole perderanno uno ione idrogeno a contatto con l’acqua.
Allo stesso modo, però potremmo ragionare al contrario: definendo le basi abbiamo detto che queste catturano ioni idrogeno, e, guardando le nostre molecole di aceto abbiamo visto degli ioni acetato catturarne alcuni. Possiamo quindi definire lo ione acetato una base, e in particolare verrà definito come base coniugata dell’acido acetico.
Per una base possiamo definire una costante di dissociazione basica, pKb, allo stesso modo con cui abbiamo definito il pKa. La somma del pKa e del pKb fa sempre 14.
Vi ricorda qualcosa?
Se state pensando al valore massimo della scala del pH avete ragione, perché sono valori strettamente collegati tra loro.
Abbiamo ora tutte le basi per definire la capacità tampone e capire a fondo cosa è il KH.
2.2 Le soluzioni tampone
In chimica, una soluzione viene definita tampone se contiene un acido debole e la sua base coniugata (o viceversa per le basi deboli) in proporzioni simili tra loro.
Non è questa la sede dei calcoli e non vogliamo tediarvi con delle formule, ma sappiate che il pH di una soluzione tampone è definito dal rapporto tra la quantità dell’acido (o base) debole e della sua base (o acido) coniugata.
Se aggiungiamo una piccola quantità, diciamo una goccia di acido solforico in un acquario pieno di una soluzione tampone, andremo a consumare una piccola quantità della base coniugata, che diventerà il suo acido, ed andremo a modificare il loro rapporto di molto poco, lasciando il pH ad un valore leggermente più basso, ma molto simile a quello iniziale.
Se nel nostro acquario di prova avessimo avuto solo acqua demineralizzata, una sola goccia di acido solforico (o pH minus) avrebbe potuto spostare il pH di uno o due punti!
Un tampone, poi, non è infinito: sarà in grado di mantenere il pH stabile fintanto che il rapporto tra l’acido e la base coniugata resterà simile. Quando la base sarà esaurita, il tampone verrà rotto, ed il pH scenderà all’improvviso. Quindi grandi quantità di acido forte in una soluzione tampone porteranno comunque ad avere un pH molto basso.
Questo effetto viene sfruttato proprio nella misura del KH: il test del KH è costituito da un acido forte (cloridrico) ed una sostanza (blu di bromotimolo) che è blu se il pH è superiore a 7, e diventa gialla quando scende sotto il valore di 6. Andando ad aggiungere una goccia, quindi piccole quantità di acido forte diluito quello che facciamo è trasformare il bicarbonato in acido carbonico fino a che non resterà più bicarbonato in soluzione. A quel punto, quando la nostra provetta sarà
diventata giallo/arancione, sapremo che il nostro tampone è stato rotto e anche la quantità di base debole presente in soluzione.
Le soluzioni sono ovviamente calibrate in maniera tale che una goccia corrisponda ad un grado di KH.
3. Il KH come tampone
Lasciando il mondo astratto della chimica e tornando al nostro acquario, il bicarbonato è una molecola che si comporta sia come un acido debole che come una base debole, ed ha quindi sia un acido coniugato: l’acido carbonico, prodotto dall’anidride carbonica a contatto con l’acqua, sia una base coniugata: lo ione carbonato, che costituisce il marmo o la soda Solvay, ad esempio.
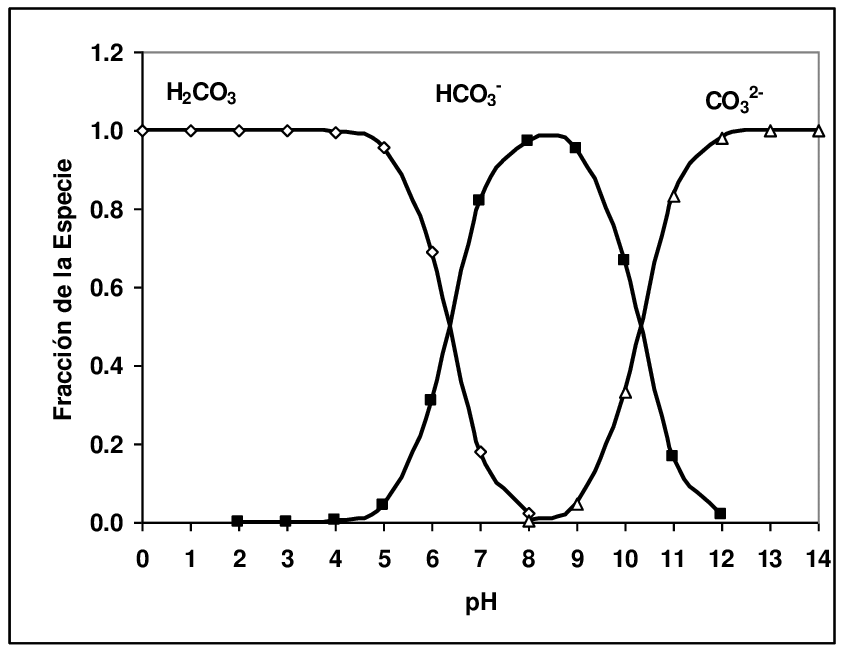
Nella tabella in alto vediamo uno schema che mette in relazione la frazione di acido carbonico, bicarbonato e carbonato a diversi valori di pH. Vediamo cosa succede se nel nostro acquario è presente unicamente ione bicarbonato, con quantità trascurabili di acido carbonico proveniente dall’aria: ci troveremo in questo caso all’apice della curva del bicarbonato (HCO3-) che si trova a circa a pH pari a 8.
Dopo anni di esperienza nel supporto agli acquariofili, posso dire che una delle domande classiche quando si parla di KH è questa:
“avevo il KH a 11 e il pH a 8, sono tre mesi che mi affatico a fare cambi d’acqua e ora sono riuscito a scendere a KH pari a 3. Perché il pH è rimasto a circa 7,8?”
La risposta è nascosta nella tabella: il pH di una soluzione di bicarbonato dipende dal rapporto tra il bicarbonato e l’acido carbonico e non dalla quantità di bicarbonato presente.
Che siano presenti pochi milligrammi o diversi grammi per litro, finché non aggiungi anidride carbonica il pH resterà sempre nell’intorno di 8, forse leggermente inferiore solo perché la poca anidride carbonica proveniente dall’aria inizia ad avere un ruolo, ma sarà sempre una decina di volte inferiore al bicarbonato, anche se ci troviamo a KH pari a 1.
Quindi, per abbassare il pH, serve aggiungere un acido, e non diminuire la capacità tampone.
E allora a che mi è servito abbassare il KH?
Aggiungiamo un impianto CO2 al nostro acquario e vediamo che succede.
Iniettando CO2 portiamo il nostro pH a 7 o anche a 6,7. Andando a vedere la quantità di acido carbonico nella soluzione, corrisponde a circa il 20-25% della quantità di tampone totale. Notate che stiamo parlando di valori percentuali e non quantità in massa. Questo perché queste percentuali restano le stesse ad ogni valore di KH possibile, che sia esso pari a 1 o 15. Poiché un punto di KH corrisponde a circa 17,8 ppm (mg/l) di bicarbonato, se il nostro KH sarà pari a 1,
l’acido carbonico a pH 7 sarà pari al 20% in proporzione, quindi pari a 3,56 ppm (pari a 17,8 x 20 / 100), a KH 15 sarà superiore in proporzione quindi pari a circa 53 ppm (confrontate la tabella pH/KH), un valore già eccessivo per gli animali.
Poiché i valori di pH ottimali per questioni di rimozione di sostanze tossiche e nutrizione delle piante sono leggermente inferiori a 7 per ragioni che discuteremo in altri articoli, sarà conveniente fare in modo che il valore del KH sia tale da avere una situazione ottimale a pH pari a 6,5-6,7, quindi a valori di durezza carbonatica pari a 3-5, e non al di sopra.
Nota a margine: lo stesso ragionamento che è stato fatto in questo paragrafo per il bicarbonato può essere fatto per la coppia ammonio/ammoniaca, che è la ragione per cui scegliamo di portare il pH a valori al di sotto della neutralità: in queste condizioni tutta l’ammoniaca, estremamente tossica per gli animali, viene trasformata in ione ammonio, più tollerabile.
3.1 La tabella pH-KH: istruzioni per l’uso
La famosa tabella “pH/KH/CO2” è valida unicamente in un sistema in cui l’acido inserito sia acido carbonico.

Se abbassiamo il KH e poi il pH con un prodotto del tipo pH minus, non andremo ad aumentare l’acido carbonico presente, ma andremo a formare un equilibrio tra acido fosforico e bicarbonato, che non porta alcun vantaggio alle piante. La tabella vale solo vale per acquari in cui non andiamo ad aggiungere additivi diversi dalla CO2 per alterare il pH e con fondo inerte.
Ci sono due casi particolari che dovremmo però prendere in considerazione: l’acquario naturale di acqua scura, e l’acquario con fondo tecnico, o allofano, se preferite.
Li tratteremo nei prossimi paragrafi.
4. Altri tamponi in acquario
Il KH è un modo di intendere la capacità tampone del nostro acquario, ma come abbiamo visto nel paragrafo su acidi e basi deboli, non è l’unico tampone esistente. Altre molecole, come l’acido acetico, o l’acido fosforico, o l’acido citrico, possono dare soluzioni con le stesse proprietà.
Se è vero che a nessuno verrebbe mai in mente di spremere un limone in vasca o riempire l’acquario di aceto (e su questo siamo tutti d’accordo, giusto?), ci sono altre possibilità in vasca.
4.1 Acquario Marino: il borato
Sappiamo, ad esempio, che in acqua dolce il potere tampone è dato unicamente dal bicarbonato. Chiunque si sia avvicinato al mondo dell’acquario marino, però, potrebbe sapere che i sali per alzare il KH di un acquario marino sono diversi, e fatti in modo da mantenere il pH a valori più alti, pari a circa 8,2-8,3. Questo avviene perché questi sali sono sì costituiti da bicarbonato per la maggior parte, ma sono anche addizionati di borato per stabilizzare i valori, che altrimenti
potrebbero salire o scendere a seconda del comportamento della vasca. Il borato aggiunge un grado di complessità al KH.
4.2 Acquario naturalistico ed acqua ambrata
Chiunque si sia cimentato realmente in un acquario d’acqua scura, poi, saprà che per raggiungere valori di pH particolarmente bassi il KH dovrà essere uguale a 0, circa. Nonostante ciò il pH resterà stabile. Questo è vero perché aggiungendo foglie, estratti vegetali, torba o legno all’acqua andremo ad aggiungere degli acidi organici, deboli e quindi in grado di produrre un debole tampone, con una forza comparabile circa a quella di un KH 2-3, ma a pH inferiore. Se andassimo ad eseguire un test di KH su quest’acqua, però, il valore risulterà essere pari a 0.
Possiamo spiegarci ciò considerando come funziona un test del KH: il colore cambia quando il pH scende sotto il valore di 6, non quando il tampone si esaurisce. Se il pH dell’acqua è già stabilmente intorno a 6, l’indicatore diventerà subito giallo, dandoci l’impressione che non sia presente alcuna capacità tampone, che invece c’è ed è importante.
Consiglio nella preparazione dell’acqua in un acquario del genere: un tampone è costituito da un acido in presenza della sua base coniugata. La presenza del solo acido non sarà sufficiente a fornire una capacità tampone efficace al sistema. Usare acqua di osmosi remineralizzata a KH 1, massimo 2 a seconda della quantità di acido che andiamo ad aggiungere, aiuterà a formare un po’ di base coniugata degli acidi fulvici, stabilizzando il pH anche a pH molto bassi, e quindi a valori illegibili di KH.
4.3 Fondi tecnici: piante e caridine
I fondi tecnici, o come molti li definiscono allofani, sono costituiti in parte da materiali argillosi, e in parte da materiale vegetale, che non colora l’acqua, ma si discioglie in essa stabilizzando il pH a valori pari a circa 6.5 o leggermente inferiori, come viene indicato dai produttori.
Questo tipo di fondi agisce sull’acqua tramite il materiale di origine vegetale, come avviene negli acquari naturali trattati nel paragrafo precedente: pH stabile, tampone non misurabile, ma presente.

Capita però che questo tipo di fondi non venga capito, anzi, spesso usato nella maniera sbagliata dalla stessa azienda per motivi… geologici.
Prendiamo ADA come esempio, perché è il più famoso e per alcuni versi il più fuorviante, ma quanto affermeremo di seguito vale per ogni fondo che ha la caratteristica di influenzare l’acidità dell’acqua. Il discorso varrà sia per i fondi dedicati alle piante, sia per i fondi dedicati alle Caridine, come le cantonensis.
ADA, capofila e più famoso esempio di produttore di questo tipo di fondi, consiglia l’uso di acqua di rete nella conduzione del suo metodo. Sebbene questa indicazione sia corretta per quanto riguarda il mercato giapponese, essa porta in Europa ad errori che costano molto sia in termini di risultato che economici all’utente: ADA è una azienda giapponese, paese interamente di origine vulcanica e con geologia completamente diversa da quella, ad esempio, italiana. L’Italia è una nazione emersa dalle acque ma residente su un bel pezzo di calcare, che è carbonato di calcio.
Le acque di rete giapponesi, come anche molte di quelle asiatiche, sono normalmente acque molto tenere , mentre la media italiana, tranne rare eccezioni, si attesta attorno a valori KH di 10-12° per arrivare anche a 30° in alcune zone termali.
Usare acqua dura su questo fondo ne altera la capacità di mantenere stabile il pH, dato che il pH verrà imposto dal tampone più forte, quello dell’acqua del rubinetto, e sarà necessario usare più anidride carbonica per nutrire le piante. Usando il fondo con KH (apparentemente) pari a 0, invece, più della metà dell’anidride carbonica disciolta in acqua sarà in forma assimilabile alle piante.
Questo ci consentirà di risparmiare grosse quantità di gas e di mantenere il pH stabile anche qualora decidessimo di usare una elettrovalvola per fermare l’erogazione durante la notte. Non solo: la quantità inferiore di anidride carbonica messa in vasca diminuirà l’aumento del KH dovuto all’uso, nel caso dovessimo sceglierle, di pietre calcaree.
Nello stesso momento, il bicarbonato potrà reagire con gli acidi presenti nel fondo, trasformandoli nelle loro basi coniugate, che sono più solubili in acqua: cambiando acqua, e questo tipo di fondi richiedono cambi settimanali del 30-50% al minimo, ci ritroveremo presto con l’aver buttato via tutto lo sforzo fatto dal produttore per far sì che il pH fosse stabile a 6.5. In breve, facendo così andiamo a diminuire il tempo di vita del fondo, e quindi dell’intero acquario, di varie volte.
Non spaventiamoci quindi, quando usiamo questo tipo di fondo, ad usare acqua a KH pari a 0, al limite pari a 1, remineralizzando solo calcio e magnesio a parte: è questo il modo corretto di agire e fare fruttare al meglio il nostro prezioso fondo.
Col passare del tempo, inteso come alcuni anni, misurando il valore del pH ci renderemo conto che non sarà più stabile come avveniva all’inizio. Potremo a tal punto cambiare gestione, inserendo bicarbonato ed aumentando la quantità di CO2 erogata, o inserire un sacchetto di fondo nuovo nel filtro, per fare disciogliere gli acidi, cambiandolo ogni una o due settimane, a seconda di quanto vediamo stabile il pH.

